Partager la publication "#EAACI2024 : un biosimilaire contre l’asthme sévère et l’urticaire chronique"
C’est la pépite qu’on vous ramène de l’EAACI de Valencia. Le laboratoire coréen Celltrion vient d’obtenir son autorisation de mise sur le marché européen par l’EMA pour Omlyclo®, un biosimilaire du Xolair®. Explications.
Un biosimilaire, c’est quoi ?
Dans la grande famille des médicaments il y a les princeps et une fois le brevet épuisé leur suite naturelle les médicaments génériques. Le médicament agit sur des petits récepteurs du corps ou sur des bactéries (les antihistaminiques, les antibiotiques, …).
Il y a aussi les biothérapies ou biomédicaments, dont les corollaires sont les médicaments biosimilaires. Ils ne sont pas issus de pratiques meilleures pour la planète ou les hommes. Ici, la syllabe « bio » fait référence à quelque chose de vivant (comme un anticorps). Un biosimilaire est l’équivalent d’un générique. Une biothérapie agit sur de très grosses molécules pour les bloquer ou les stimuler. Elle est active directement sans avoir besoin d’être métabolisée (par le foie le plus souvent), comme les médicaments anciens. Une biothérapie est un agent biologique, vivant, comme un anticorps par exemple. C’est un agent complexe là où un médicament est « simple ». C’est une innovation importante dans le traitement de nombreuses maladies qui soigne avec efficacité des cancers, mais aussi l’asthme. A retenir également, un biosimilaire n’est pas une copie parfaite car il s’agit d’un médicament biologique, pas chimique.
Omalizumab, une innovation qui a déjà 20 ans
L’omalizumab est le nom d’un agent complexe de biothérapie, (comme le paracétamol pour un médicament simple). L’omalizumab est un anticorps monoclonal issu de l’ADN recombinant (voilà voilà). Il a été développé par le laboratoire Novartis pharma sous le nom commercial Xolair®. La seringue préremplie de 1 ml dosée à 150 mg coûte 320 euros en France, remboursée à 65 % par la Sécurité sociale. À raison de une à quatre injections par mois c’est un vrai budget et on se dit, que les asthmatiques français ont de la chance de pouvoir se soigner avec cette biothérapie, qualifiée par le Vidal de médicament d’exception, et de bénéficier d’un traitement à la pointe de l’innovation sans effort financier si ce n’est sa mutuelle. Depuis tout juste 1 mois, les allergologues de ville peuvent le prescrire. Auparavant, seul le milieu hospitalier y était autorisé. Cette biothérapie est indiquée en cas d’urticaire chronique, d’asthme allergique sévère et de polypose nasale.
Le brevet industriel de Xolair® arrive au terme de ses 20 ans, permettant à d’autres laboratoires de se saisir de l’omalizumab pour proposer un biosimilaire.
Omlyclo®, ce qu’il a en plus, ce qu’il a en moins
Le groupe Celltrion présent sur le congrès de l’EAACI de Valencia en Espagne du 31 mai au 2 juin 2024, a annoncé l’acceptation de son biosimilaire Omlyco®, par l’agence européenne du médicament. Qu’est ce qu’il a en plus, qu’est-ce qu’il a de moins que son grand frère breveté ?
Le biosimilaire Omlyco® comporte de l’omalizumab, en deux dosages 75 mg et 150 mg. Il n’y a pas de citrate dans la formulation parce que c’est plus douloureux à l’injection. Et pas non plus de latex au niveau de l’aiguille de la seringue préemplie.
La prochaine étape avant de voir Omlyclo® dans les pharmacies de ville et hospitalières de France, et du Benelux est la fixation des prix de commercialisation avec chaque pays. Ce qui prend un temps certain. En Espagne et au Portugal c’est Kern Pharmaceutics, un partenaire de Celltrion qui commercialisera Omlyclo®, et en Suisse c’est Icône qui distribuera le biosimilaire.
Les négociations sur le prix en France risquent d’être féroces et le biosimilaire devra forcément être bien moins cher que Xolair®.
Et les ruptures de stock ?
Même si les prix de vente sont différents d’un pays à l’autre, Celltrion affirme pouvoir fabriquer les quantités nécessaires pour tous et n’aura pas à choisir de distiller ou supprimer un approvisionnement pour faire du chiffre d’affaires. Il y a deux usines en Corée, une troisième est en construction. L’entreprise comporte 2200 salariés et compte sortir un nouveau biosimilaire chaque année. La stratégie de développement de Celltrion évoque celle de Teva en son temps, génériquer des biothérapies dont les brevets de protection arrivent à terme et distribuer en masse (110 pays), plutôt que d’investir dans la recherche qui nécessite un effort financier long et audacieux. Leurs forces sont un réglementaire ultra efficace et une production de masse. Celltrion France se situe à Issy-les-Moulineaux et commercialise déjà 5 biosimilaires dans des domaines thérapeutiques divers.
Les trucs en plus
• Celltrion a été créé en 2002 à Incheon en Corée du Sud. Son nom est bâti sur le mot cellule en anglais et Triones en référence à l’étoile directrice de la Grande Ourse.
• On trouve des vidéos sur le site internet du groupe pour utiliser correctement une seringue pré emplie et s’auto injecter le produit en sous-cutané. Capture d’écran. Il paraît que les patient auront même un petit sac e transport pour leur traitement.
• La FDA (l’agence américaine du médicament) vient d’accorder une nouvelle indication à l’omalizumab, dans l’allergie alimentaire. Le Dr Quequet vous en a parlé en mars dernier.
•Lors de la session de dimanche « Peanut. Different routes, different outcomes ? », un comparatif a été fait prix/efficacité de plusieurs méthodes d’induction de tolérance à l’arachide. Patch intradermique, ITO, et bien sûr omalizumab. Le Dr Paul J. Turner a réalisé un joli tableau mettant en comparaison les 10 £ de cacahuète nécessaires en un an pour une ITO, contre un traitement sous Xolair® à 12295 £ en UK pour une durée inconnue.
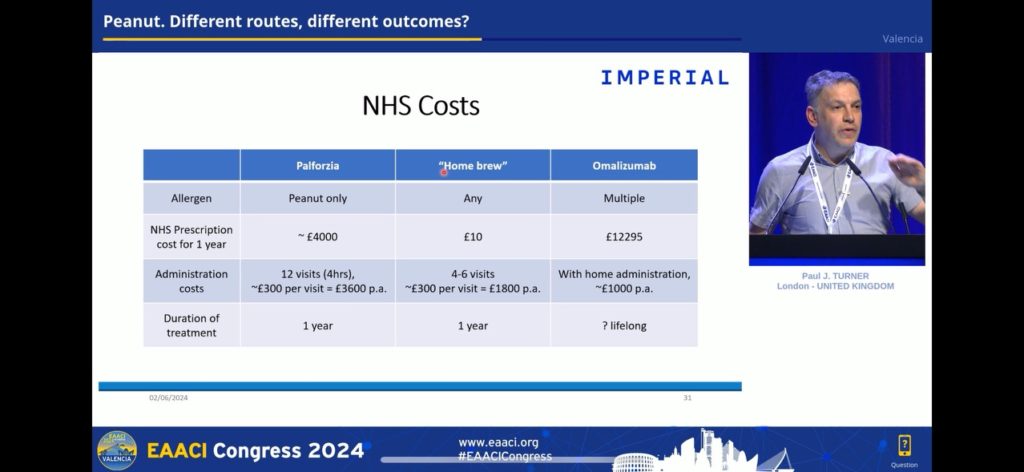
illustration : Photo Véronique Olivier
A lire encore :
